The introduction and analyzation of protein
蛋白质的四级结构
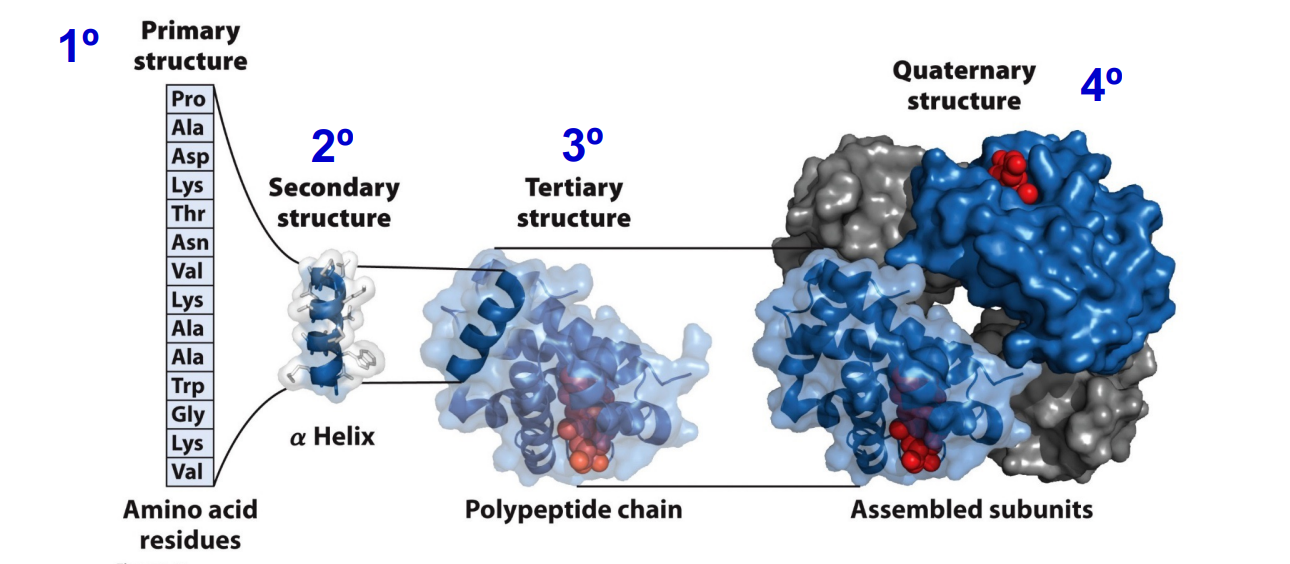
蛋白质是由氨基酸聚合而成的大分子多肽链并折叠形成特定的3D结构。
蛋白质的一级结构:氨基酸的序列
蛋白质的二级结构:多肽链主链骨架本身,在空间上有规律的折叠和盘绕,主要相互作用是氢键;由氨基酸的一级结构决定。
蛋白质的三级结构:是指多肽链在二级结构的基础上进一步盘绕,卷曲,折叠,形成主要通过侧链以次级键以及二硫键维系的完整三维结构。
蛋白质的四级结构:在进行相关作用时,可能存在多个蛋白形成多聚体以发挥功能。(不是所有的蛋白都具备)
由于蛋白质存在这样复杂的四级结构,因此蛋白质具有极高的多样性。
基于功能的蛋白质的分类
- 酶(催化)
- 结构蛋白(角蛋白、胶原蛋白)
- 运输功能(通道蛋白)
- 信息传递(激素,受体)
- 免疫防御(抗体)
- 运动(肌动蛋白,肌球蛋白)
- 储存(豆类种子蛋白)
- ···分子伴侣、荧光蛋白、微管蛋白····
基于结构单元多少的蛋白质分类
- 单体蛋白质:仅有一条多肽链构成。
- 多聚(寡聚)蛋白质:由两条或多条肽链构成的蛋白(eg. 血红素)
- 几条以非共价肽键连接的肽链形成的蛋白质称为蛋白复合体,其中每一条肽链组成的结构称为亚基;亚基具有相对独立的结构域,具有完整的三级结构
基于复杂程度的蛋白质分类
- 简单蛋白质:仅有氨基酸组成
- 缀合蛋白质/复合蛋白质:含有除氨基酸以外的化学成分作为永久结构的一部分。
- 辅基或配体:复合蛋白质上的非蛋白质成分。
基于形状的蛋白质分类
- 纤维蛋白:α-角蛋白,胶原蛋白(前两个都是α螺旋)、丝心蛋白(β折叠,平行)
- 力量,灵活,疏水,简单重复序列(二级结构)
- 球状蛋白:肌红蛋白、血红蛋白,大部分酶 (球蛋白形成的驱动力是疏水基团的埋藏和有序水的释放)
- 膜蛋白:
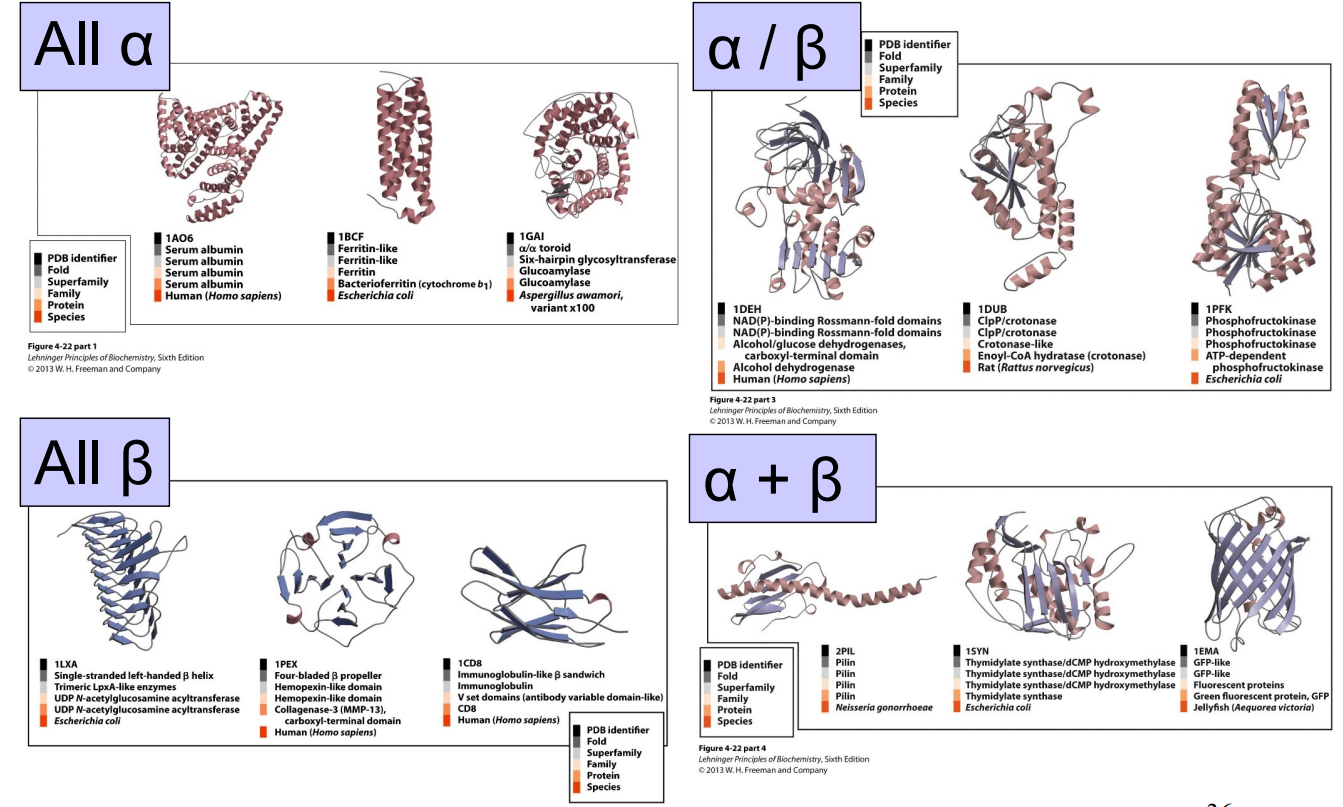
根据蛋白质结构功能进行的分类
- 基序是蛋白质结构分类的基础
- 4类蛋白α,β,α+β,α/β
- 蛋白质氨基酸序列相似/三级结构和功能相似属于同一蛋白质家族
- 不同基序,但功能相似属于一个超蛋白质家族
蛋白质的主要成分
- 组成元素:C、H、O、N、S
- 平均含氮量16%
蛋白质的质量
氨基酸残基的平均分子量为110,因此蛋白质的分子量可以近似为氨基酸数x110
蛋白质的稳定性
通常未折叠的肽链具有极高的结构熵,并与溶剂(通常是水)形成相互作用。蛋白一旦(以二硫键或弱的相互作用[1])发生折叠将会放出约20-60 kj/mol 的能量(远小于C-C,C-H键)。
- 二硫键:二硫键的形成需要氧化的环境(两个巯基脱氢),然而细胞质中通常是一个还原环境,因此二硫键在内质网中形成,通常存在于膜蛋白和细胞外介质的蛋白中(内质网分泌囊泡···)
对于原核生物,二硫键常存在于嗜热细菌和古细菌中,因为二硫键有助于在高温下稳定蛋白质结构。 - 疏水作用:通常疏水的氨基酸侧链都聚集蛋白质内部,远离水。暴露的疏水分子破坏了周围水分子间氢键,使其溶剂化,进一步形成一个牢笼将疏水分子囚禁在里面,进而使得分子的结构稳固。
对于酶-底物相互作用,氢键,离子相互作用,疏水作用力都使得底物和酶的结合更加稳定。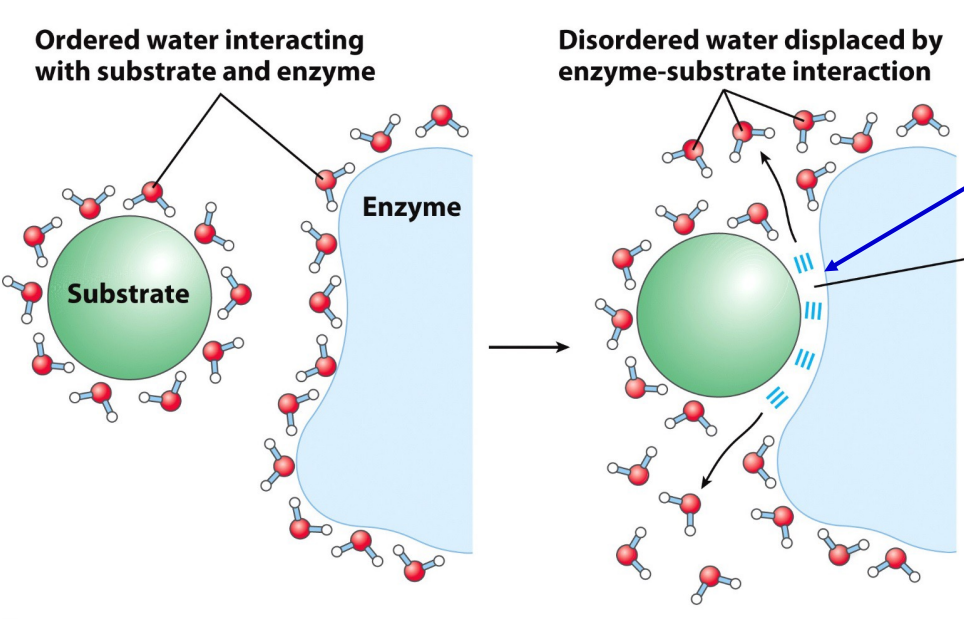
有序水的释放和分子内极性相互作用的形成为折叠提供了熵的驱动力。蛋白质内的氢键和粒子相互作用的数量是最大的(未配对的极性或带电基团都使得蛋白质不稳定)
蛋白质的一级结构
多肽
多肽是有氨基酸脱水缩合形成的小聚合物,与蛋白相比较小。
脱水缩合反应:
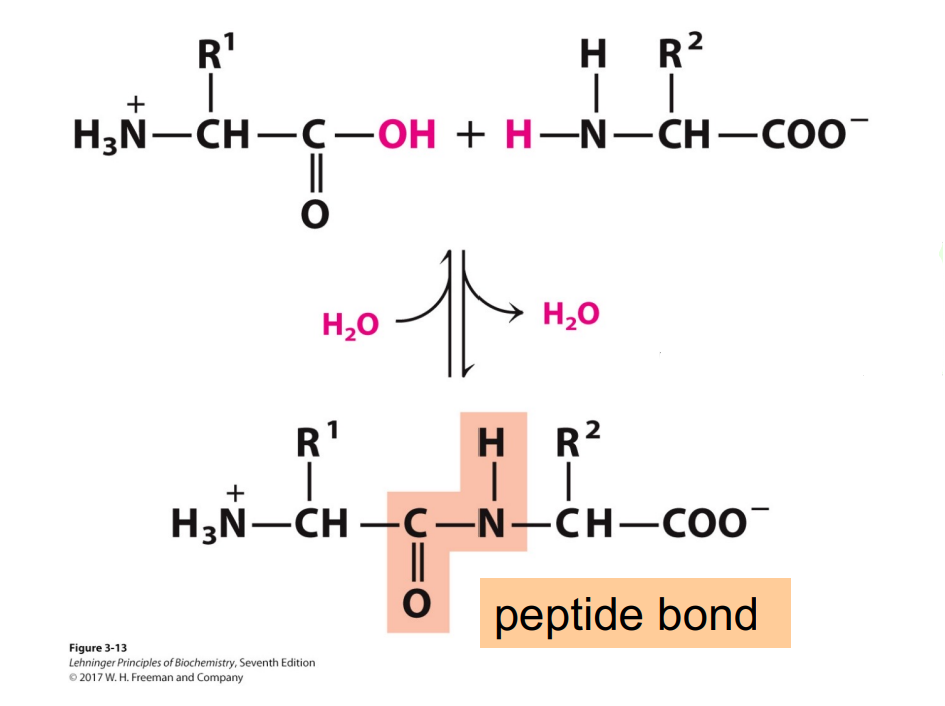
- 反应场所:核糖体内
- 命名方式:由N端到C端的顺序
- 全拼:– serylglycyltyrosylalanylleucine
- 简拼:– Ser-Gly-Tyr-Ala-Leu
- 单字母简写:– SGYAL
- 多肽的特征:
- 等电点:与氨基酸相同。
- 多肽的功能:
- 激素和信息素
- 神经递质
- 抗生素:杆菌肽
- 毒素:绿毒素
- 与多肽结合后的发挥作用的物质:
- 辅助因子
- 辅酶:
- 非阮基基团:肌红蛋白中的血红素
- 蛋白序列在进化上的应用:
- 具有相同功能的蛋白质序列可以从广泛的物种进行排列和分析差异。差异表明它们在进化上存在分歧;同样的,对多个蛋白家族到的分析可以表明生物之间的演化关系,借以揭示地球上的生命演化史。
- 一致性序列反映了每个位置上最常见的残差,往往较为保守的区域对蛋白质的功能很重主要(一旦突变就彻底失去活性,以至于可能无法将该遗传物质传递给后代)。
- 多肽的结构特征
- 肽键:肽键的C-N单键因为超共轭效应具有一定的双键的性质,因此在旋转上有一定程度的限制。
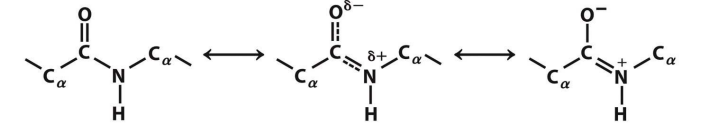
- 共振产生的肽键:比酯反应性低,刚性近平面,在有利的的反式构象中表现出较大的偶极矩。[2]
- 肽平面:由于肽键的旋转限制,我们可以将两个α碳之间的部分看作一个平面。
- 肽平面由其对应的二面角决定,决定二面角的两个旋转角分别是
:
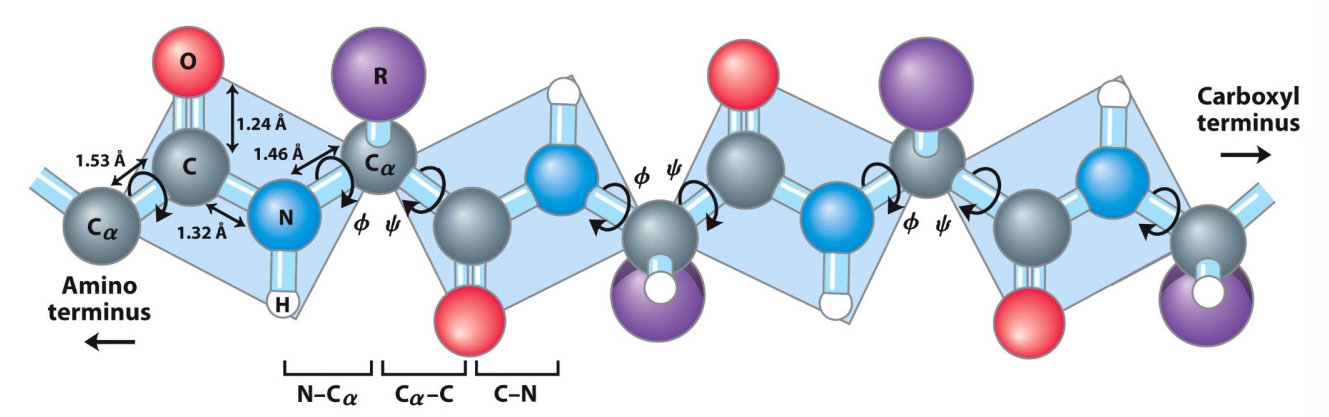
- 肽平面由其对应的二面角决定,决定二面角的两个旋转角分别是
- 肽键:肽键的C-N单键因为超共轭效应具有一定的双键的性质,因此在旋转上有一定程度的限制。
蛋白质的二级结构
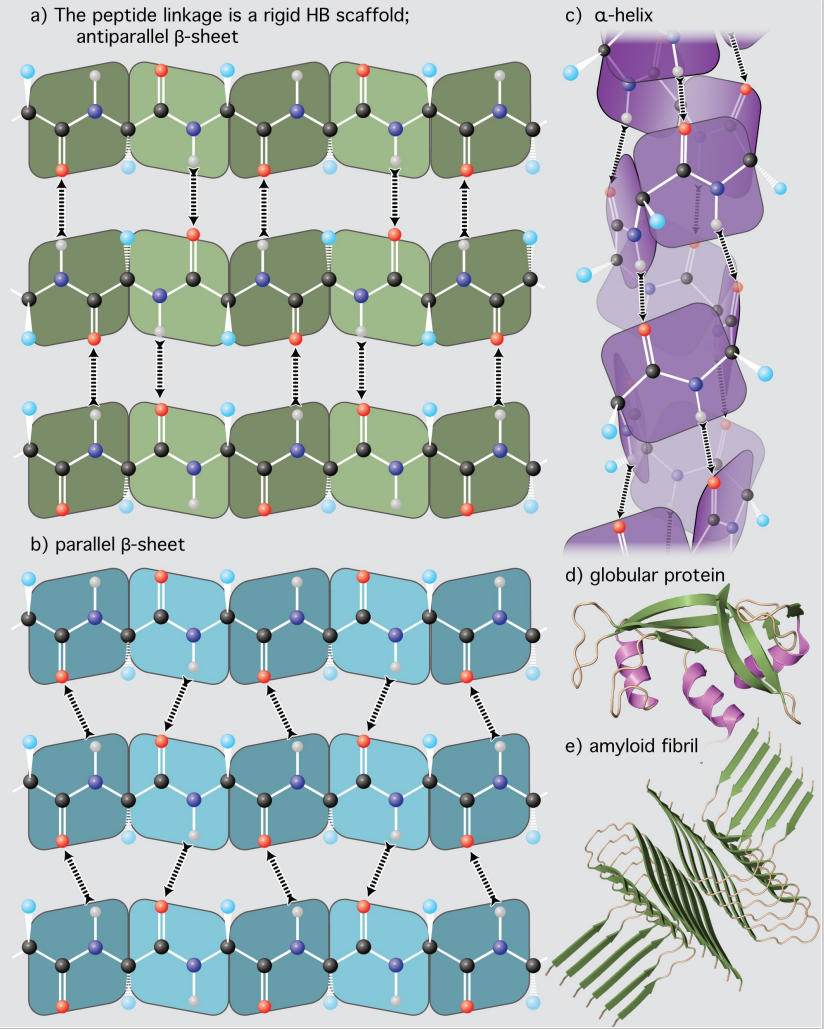
蛋白质的二级结构通常分为两种:
- α螺旋:由临近残基之间的氢键稳定
- β折叠:由可能在附近的相邻段之间的氢键来稳定
α螺旋
α螺旋是非常常见的,占蛋白质中氨基酸4%的结构,氨基酸的序列影响α螺旋的稳定性,如:Met,Ala,Arg,Leu,Glu,Lys有利于形成螺旋,Gly,Pro不利于α螺旋的形成(Pro的C-N键不易旋转,Gly较为灵活,熵成本高,不利于氢键的形成)
- 相互作用:带正电的氨基酸在离带负电的氨基酸残基3或4个位置的地方有利于形成离子对,相隔3或4个位置的芳香残基可以形成疏水相互作用。氢键通常由氨上的氢与羧基上的氧之间形成。
- alpha螺旋的结构:首先α螺旋并非是空心的,其次其螺距约为5.4埃,约有3.6个氨基酸残基为一圈。
- 左旋和右旋:通常情况下D型氨基酸更易形成左旋,L型更容易形成右旋。
- α螺旋两端的带电残基因α螺旋偶极子而稳定,N端带正电,C端带负电。
- 帽化:所谓帽化就是给末端裸露的N-H和C=O提供仅见氢键配偶体(partner),并折叠蛋白质的其他部分以促成与末端的非极性残基的疏水作用。由于α螺旋的偶极矩的存在,帽化氨基酸最好能够中和两端的电荷。
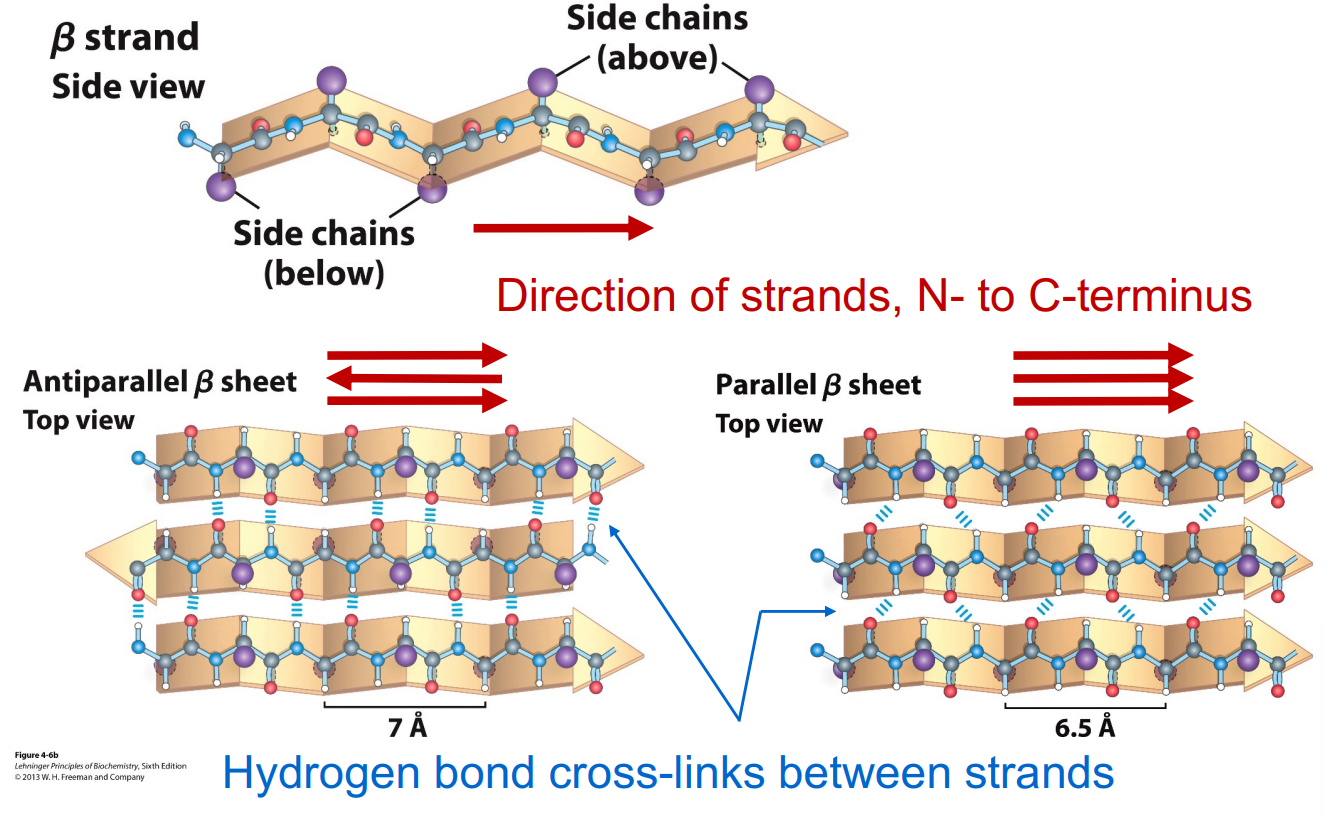
β折叠
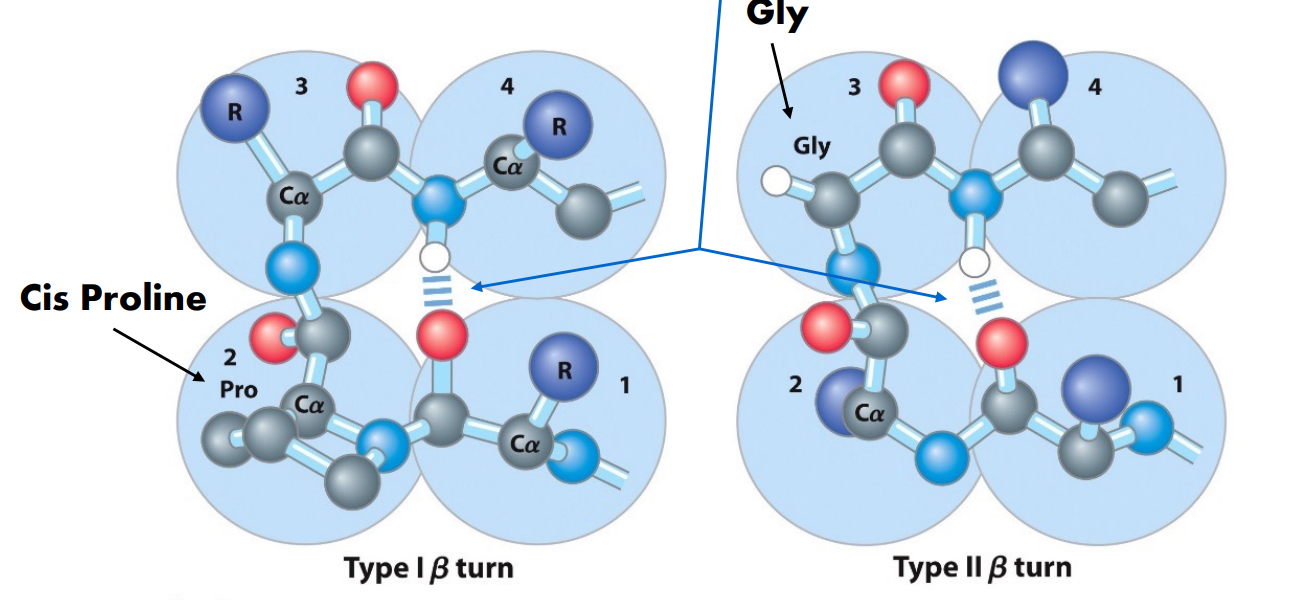
β链之间形成氢键形成β片,单个β链在线性氨基酸中可能很近也可能很远,β链可以形成平行或反平行的β片,β turn连接β链的两端,Gly和Pro的残基常出现在β turn上,每个β片至少有两个β链。β链之间可以是平行,反平行的。
- beta turn: 使得氨基酸链180度旋转,旋转由4个氨基共同完成,由氢键稳定,在序列上由三个残基,2号位和3号位常见Pro和Gly。
圆二色谱检测蛋白二级结构
L6
蛋白质的超二级结构和结构域
L6
基序
蛋白质根据基序和功能进行分类
蛋白质的三级结构和四级结构
X
核磁
冷冻电镜